第三章 胃癌
第一节 概述
一、 发病情况
胃癌是目前全球最常见的恶性肿瘤,最近的全球数据—— GLOBOCAN 2012 显示2012 年全球肿瘤流行病统计数据:全球新增约1 410 万例癌症病例,癌症死亡人数达820 万。每年新发胃癌患者约100 万,死亡70 万,占总死亡人数的8.8%。最新的美国数据—— CA 杂志刊登美国2016 年癌症统计数据显示:2016 年美国估计新增约168.521 万例癌症病例,癌症死亡人数约59.569 万。胃癌总发病2.637 万例(1.6%),总死亡1.073 万例(1.8%)[1]。最新的中国数据—— CA 杂志刊登的文章显示,利用2000 - 2011 年数据预测中国年癌症发病情况:2015 年中国癌症总发病429.16 万例,总死亡281.42 万例,胃癌发病和死亡人数均排名第二位,总发病67.91 万例(15.8%),总死亡49.8 万例(17.7%)。其中农村居民中胃癌更在所有癌症中发病和死亡均排名第一,总发病44.4 万例,总死亡33.51 万例[2]。尽管近年来胃癌一级二级防治工作的开展,使早期胃癌的检出率提高,但中晚期患者仍占70% 左右。中晚期胃癌无根治性手术指征,5 年生存率低。因此有必要了解胃癌的临床特点以及诊疗规范,提高早诊早治率,改善胃癌患者生存状况。
胃癌的病因迄今尚未阐明,但多种因素会影响胃癌的发生。目前所知主要与下列因素相关:①幽门螺杆菌感染;②亚硝基化合物;③高亚硝酸盐的摄入;④二羰基化合物;⑤真菌;⑥遗传性。
建议对胃癌患者进行遗传学评估。遗传性弥漫性胃癌(HDGC)是最常见的遗传学胃癌,这是一种常染色体显性遗传综合征,其特点是弥散性胃癌为主,且在年轻时发病。有30% ~ 50% 的遗传性弥漫性胃癌家庭有抑癌基因CDH1 的种系突变。其他如Lynch综合征、Peutz-Jeghers 综合征、家族性腺瘤样息肉病(FAP)等胃癌发病概率也明显增加。
二、 诊断和分期
(一) 临床诊断
胃癌缺少特异性临床症状,早期胃癌常无症状。常见的临床症状有上腹部不适或疼痛、食欲减退、消瘦、乏力、恶心、呕吐、呕血或黑便、腹泻、便秘、发热等。肿瘤发生于贲门者有进食时哽噎感,位于幽门部者食后有饱胀痛,偶因肿瘤破溃出血而有呕血或柏油便,或因胃酸低、胃排空快而腹泻,或患者原有长期消化不良病史,致发生胃癌时虽亦出现某些症状,但易被忽略。少数患者因上腹部肿物或因消瘦、乏力、胃穿孔或转移灶而就诊。
(二) 体征
早期或部分局部进展期胃癌常无明显体征。晚期胃癌患者可扪及上腹部包块,发生远处转移时,根据转移部位,可出现相应的体征。发生上消化道穿孔、出血或消化道梗阻等并发症时,可出现相应体征。
(三) 辅助检查
1. 实验室检查 血常规、血液生化学、血清肿瘤标志物(如CEA 和CA19-9 等)、尿液和粪便常规、粪隐血试验等检查。
2. 内镜检查
(1) 胃镜检查:确诊胃癌的必需检查手段,可确定肿瘤位置,获得组织标本以行病理检查。必要时可酌情选用色素内镜或放大内镜。
(2) 超声胃镜检查:有助于评价胃癌浸润深度,判断胃周淋巴结转移状况,推荐用于胃癌的术前分期。对拟施行内镜下黏膜切除(EMR)、内镜下黏膜下层切除(ESD)等微创手术者必须进行此项检查。
(3) 腹腔镜:对T3 ~ 4 或N+者,可考虑腹腔镜检查。
3. 影像学检查
(1) 计算机断层扫描(CT):CT 平扫及增强扫描在评价胃癌病变范围、局部淋巴结转移和远处转移状况等方面具有重要价值,应当作为胃癌术前分期的常规方法。在无造影剂使用禁忌证的情况下,建议在胃腔呈良好充盈状态下进行增强CT 扫描。扫描部位应当包括原发部位及可能的转移部位。
(2) 磁共振(MRI)检查:MRI 检查是重要的影像学检查手段之一。推荐对CT 造影剂过敏者或其他影像学检查怀疑转移者使用。MRI 有助于判断腹膜转移状态,可酌情使用。
(3) 上消化道造影:有助于判断胃原发病灶的范围及功能状态,特别是气钡双重对比造影检查是诊断胃癌的常用影像学方法之一。对疑有幽门梗阻的患者建议使用水溶性造影剂。
(4) 胸部X 线检查:应当包括正侧位相,可用于评价是否存在肺转移和其他明显的肺部病变,侧位相有助于发现心影后病变。
(5) 超声检查:对评价胃癌局部淋巴结转移情况及表浅部位的转移有一定价值,可作为术前分期的初步检查方法。经腹超声检查可了解患者腹腔、盆腔有无转移,特别是超声造影有助于鉴别病变性质。
(6) PET-CT :不推荐常规使用。对常规影像学检查无法明确的转移性病灶,可酌情使用。
(7) 骨扫描:不推荐常规使用。对怀疑有骨转移的胃癌患者,可考虑骨扫描检查。
4. 细胞学检查 腹水细胞学或术中腹腔冲洗或灌洗细胞学检查可明确是否存在腹腔游离癌细胞(FCC),对指导临床分期具有重要意义。
(四) 病理诊断
1. 胃癌的大体分型
(1) 早期胃癌大体类型:Ⅰ :隆起型;Ⅱ a :表面隆起型;Ⅱ b :平坦型;Ⅱ c :表面凹陷型;Ⅲ:凹陷型。
(2) 进展期胃癌的大体类型:
1) 隆起型:肿瘤的主体向肠腔内突出。
2) 溃疡型:肿瘤深达或贯穿肌层合并溃疡。
3) 浸润型:肿瘤向肠壁各层弥漫浸润,使局部肠壁增厚,但表面常无明显溃疡或隆起。
2. 胃癌的组织学类型
(1) WHO 分类:目前最为常用的胃癌组织学分型方法,分为乳头状腺癌、管状腺癌、黏液腺癌、印戒细胞癌、腺鳞癌、鳞状细胞癌、未分化癌等。
(2) Lauren 分类:肠型、弥漫型、混合型。
3. HER2 检测 建议经病理诊断为胃癌的病例均行HER2 检测,对于新辅助治疗后的病灶以及复发和转移病灶,建议重新进行HER2 检测[3]。
三、 分期诊断
1. TNM 分期标准(表3-1)
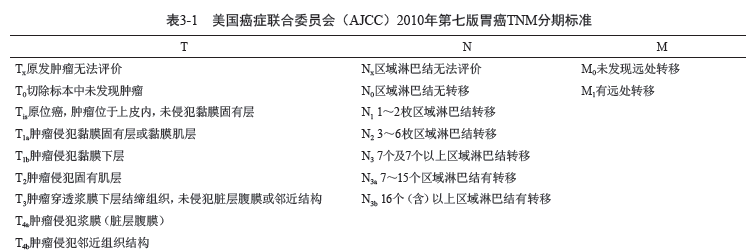
2. 分期(表3-2)

四、 总体治疗原则
胃癌的治疗强调多学科专家(MDT)讨论的综合治疗,确定治疗方案的基础则为胃癌病理诊断、临床分期、分子病理分型以及患者的身体状况等。目前超声内镜、CT、MRI 及腹腔镜等在内的影像学技术的进步使得术前临床分期有了很大改进,对于多数病例可以准确判断胃癌是否属于局部进展期或已发生远处转移。在明确患者分期的同时,还应对患者进行系统的体格检查及病史询问,了解脏器功能及常规实验室检查结果,以此明确患者体力状况、治疗耐受性及潜在治疗风险。同时还应根据能否进行根治性手术切除及体力状况对患者进行分类,推荐由肿瘤内科、外科、放射治疗科、介入科、影像科、病理科、营养科、分子生物信息学团队及护理人员等进行多学科评估,共同制订治疗策略和具体实施方案与计划,并在整个治疗过程中定期进行随诊再评估,以便及时修订下一步治疗计划。
根据不同的分期治疗目标不同,早期胃癌不伴淋巴结转移者可根据侵犯深度考虑内镜下治疗或手术治疗,术后无须进行辅助放疗或化疗;局部进展期胃癌或伴有淋巴结转移的早期胃癌应采取以手术为主的综合治疗手段,根据肿瘤病理特征、侵犯深度及是否伴有淋巴结转移等因素综合判断,是直接进行根治性手术或先术前进行新辅助化疗,待肿瘤降期后再行根治性手术,成功实施根治性手术的局部进展期胃癌需根据术后病理及分期决定辅助治疗方案(辅助化疗,必要时考虑辅助放化疗);转移性胃癌应采取以化疗为主的综合治疗手段,在恰当的时机给予姑息性手术、放射治疗、介入治疗、射频治疗等局部治疗手段,同时也应积极给予止痛、心理、营养等最佳支持治疗。因临床分期同病理分期存在不一致性,或治疗过程病情发生变化,因此不论其分期均应在治疗过程中重新评估患者病情,采取更适宜的治疗方法。
第二节 胃癌围手术期化疗和合理用药
一、 新辅助化疗
新辅助化疗(neoadjuvant chemotherapy)是指能够获得根治性手术的患者在术前接受的化疗。新辅助化疗可以达到降期和减少术后复发转移概率。针对者为无远处转移的局部进展期人群,新辅助化疗的目的不同于已经存在广泛转移的晚期胃癌的姑息化疗,其治疗是以根治肿瘤为目的,希望能够在保证安全性的前提下,通过化疗使原发病灶缩小,减少向腹腔内侵犯,与周围脏器界限清晰,减少手术难度,短期内实现肿瘤降期,此时再行手术以提高R0 切除率;同时能够控制微小转移病灶,减少术后的复发转移,以延长患者总生存期和无病生存期。新辅助治疗不仅可以提高手术根治性切除率,同时还可以获得明确的疗效判断,对于术后辅助化疗方案的选择提供了依据,是患者术后辅助化疗方案选择的最重要决定因素之一。
因为新辅助化疗的目的是要在短期内实现肿瘤降期,因此选择化疗药物时首要原则为高效低毒的联合化疗方案,避免选择单药。ECF 方案已有循证医学依据。在晚期胃癌的REAL-2 研究中比较了ECF、EOF、ECX 和EOX,显示奥沙利铂替代顺铂、卡培他滨替代5-FU 均具有类似或更优的疗效和安全性,因此上述4 种方案均可用于胃癌的新辅助化疗[4]。除此以外,根据国内外临床研究探索,紫杉烷类药物为基础的联合化疗方案如DCF、PCF、DX、PX,奥沙利铂为基础的两药联合方案如FOLFOX、XELOX 等,初步显示有提高手术切除率的作用,而对于术后长期生存的影响还需要随机对照研究去证实。
关于新辅助化疗周期数目前尚无定论,在没有远处转移的局部进展期患者中,T3N1 的患者一般需要8 ~ 9 周的术前辅助化疗;对于T3N2 或T4 以上分期的患者应适当延长,需要8 ~ 9 周以上。但应注意及时评估疗效,部分无效的患者应尽快转入手术程序。未来的新辅助化疗仍应根据患者的肿瘤侵犯情况、淋巴结转移情况、分子分型、标志物筛选等指标进行人群的细化筛选,并且要求手术质量高,避免新辅助化疗成为非标准手术的挽救手段。
对于接受新辅助化疗的局部进展期胃癌患者,手术仍是最关键的治疗。要求应按标准规范的手术模式进行治疗,并详细观察术后并发症,记录手术过程和结果,以及术后规范病理报告。术后患者在手术应激期度过之后,首要面对的问题是如何选择辅助化疗方案,此时需要依据患者身体状况、基础疾病,结合手术前化疗疗效和不良反应、手术所见和手术结果、术后并发症和术后病理类型和新辅助化疗前以及术时TNM 分期,来选择高效低毒的化疗药物,并注意药物的不良反应和长期毒性。有效者可以继续使用术前所用的新辅助化疗方案,但一定要考虑患者术后消化道重建带来的病理生理变化,以及重复化疗的耐受性,必要时适当调整,或联合放疗。新辅助化疗无效者应另选药物或方案,或联合放疗。
药物治疗选择:氟尿嘧啶类、铂类、紫杉烷类药物和蒽环类药物是常见的术前新辅助化疗药物。根据患者的身体状况,ECF、DCF 以及氟尿嘧啶类联合铂类或紫杉烷类的两药联合化疗方案均可使用。
二、 辅助化疗
辅助化疗是在根治性手术后采用的化疗,是肿瘤根治性治疗的重要组成部分。其目的是针对可能存在的微小转移灶,尽可能降低或延缓复发转移的风险。一项纳入12 项随机临床研究的关于胃癌D1 以上根治术后辅助化疗的荟萃分析结果显示,术后辅助化疗较单独手术可降低22% 的死亡风险,该分析中包括4 项日本研究、8 项欧洲研究,纳入标准严格,除外仅含T1 期患者和进行D0 手术的研究,与目前临床实践相符,结果较为可信[5]。随后两项大样本Ⅲ期临床研究的结果,为胃癌根治术后辅助化疗的价值提供了有力的依据。
ACTS-GC 研究[6]及CLASSIC 研究[7]两项大样本Ⅲ期对照临床研究显示,即使施行了D2 淋巴结清扫术,对于AJCC 6.0 TNM 分期系统下的Ⅱ期、Ⅲ a期和Ⅲ b 期胃癌术后患者,接受S-1 单药或者XELOX的辅助化疗,仍然可以显著改善远期生存,使之成为标准术后辅助化疗方案。如术前未能进行新辅助化疗,术后病理分期为Ⅱ期或Ⅲ期胃癌患者,原则上均应给予术后辅助化疗。根据这两项研究的结果,对于胃癌根治术后(D2 淋巴结清扫术)的患者,Ⅱ期患者可采用S-1 单药辅助治疗1 年或者XELOX 术后8 周期(6 个月),两种治疗方案都可以接受;但对于Ⅲ b 期患者,倾向于推荐后者。当然胃癌根治术为需要消化道重建的大手术,每例患者的基础疾病、术后恢复情况及体力状况等均存在较大差别,需结合具体情况选择术后辅助化疗方案。
在现有循证医学依据下,目前基本公认:对于早期胃癌患者,即便不接受辅助化疗,术后5 年生存率也达90% ~ 95%,因此不推荐术后进行辅助化疗。而对于T2N0M0 患者,传统意义上的高危因素,如低分化,淋巴管、血管、神经受侵,年龄小于50 岁者,从术后辅助放化疗也可能获得生存期延长,但尚缺乏证据支持。INT0116 研究[8]纳入部分pT2N0M0 患者,也从辅助放化疗中获益,但由于INT0116 中胃癌根治术式为D0 + D1 者高达90%,而D2 根治术仅占10%,日本JCOG 9206-1 研究及韩国Kim 的研究显示辅助化疗不能给D2 根治术后T2N0M0 患者带来生存益处。因此,对于T2N0M0 的患者,如不具有上述高危因素,或手术规范(D2 术式),一般不推荐术后辅助化疗。
对于根治手术切除有困难或不可能,且无远处转移的局部晚期胃癌患者,应尽量争取联合化疗或放化疗,创造再次手术根治的可能,这样的治疗称之为转化治疗,目的是降期,使肿瘤范围缩小,而获得根治性切除的机会。
药物治疗选择:对于术前曾经接受新辅助化疗的患者,在根治手术后,如原方案治疗有效,仍可采用原方案进行辅助化疗,但要根据患者术后消化道重建等原因带来患者身体状况的改变来调整治疗方案和剂量。对于术前未行新辅助治疗的术后辅助化疗可考虑S-1 单药或者XELOX 两药联合的辅助化疗。
对于腹膜转移风险高的患者,术后或术中腹腔化疗或热灌注化疗也有诸多临床研究,初步结果显示了很好的临床应用前景,5-FU、顺铂、紫杉烷类药物是常选择的腹腔化疗药物,但用药时机、剂量以及与全身化疗如何联合、对生存状态的影响等问题尚未解决,仍需要继续探索。
第三节 胃癌姑息化疗和合理用药
一、 概况和基本治疗原则
(一) 姑息化疗概况
我国大约40% 的胃癌患者就诊时已到晚期。即使根治术后的患者仍有40% ~ 60% 出现复发转移,加上现有治疗手段患者获益有限,导致晚期胃癌患者预后很差,仅给予对症支持治疗的患者,生存期为3 ~ 6 个月,接受化疗治疗的患者中位生存期也多不超过12 个月。
与有望通过以手术为主的综合治疗模式实现治愈的局部进展期胃癌不同,不能手术、非根治术或根治术后复发转移无法再切除的晚期胃癌患者,由于不可能治愈肿瘤,其治疗目的已转变为缓解症状,提高生活质量并延长生存期。如无化疗禁忌都应采取以药物治疗为主的综合治疗措施以实现上述治疗目标。随着分子生物学的飞跃进展,分子靶向药物也已进入临床使用,如曲妥珠单抗,联合化疗进一步改善了晚期胃癌HER2 阳性患者生存状况[9]。对于不能接受姑息化疗的患者应提供最佳支持治疗,缓解症状,提高患者的生活质量。
多学科综合治疗仍是晚期胃癌主要治疗模式,在药物治疗实现疾病控制后,应适时考虑放射治疗、介入治疗、射频治疗,甚至是姑息性手术等局部治疗手段的介入,以实现症状缓解、疾病控制、生存期延长和生活质量改善。上述各种治疗手段在临床实践中普遍使用,遗憾的是缺乏严谨设计的临床研究对其进行总结和分析,近期两项针对转移性胃癌手术治疗联合药物治疗的临床研究都未获得成功,所以如无出血、梗阻、穿孔等并发症,一般不主张手术切除胃癌病灶。但很多问题仍需继续临床探索,这需要各个临床治疗科室通力合作,共同提高晚期胃癌临床研究的水平,推动临床实践的发展。
(二) 治疗前评估及用药原则
对于Karnofsky 评分≥60 或ECOG 评分≤2 的患者给予以全身化疗为主的综合治疗,胃癌患者体质个体差异较大,应根据患者身体状况和经济条件选择化疗的单药方案、双药方案或三药方案,再根据患者肿瘤组织分子检测状况选择是否加用分子靶向治疗药物。对于身体条件较差无法化疗的患者应给予最佳支持治疗。
(三) 治疗目标和策略
晚期胃癌患者治疗目标主要是延长生存期,提高生活质量。由于目前化疗方案疗效有限,并且其毒副作用较大,一般胃癌患者体质较差,因此治疗的每个时期均应充分评估患者的得失,结合患者的意愿制订个体化的治疗方案。
二、 药物治疗选择
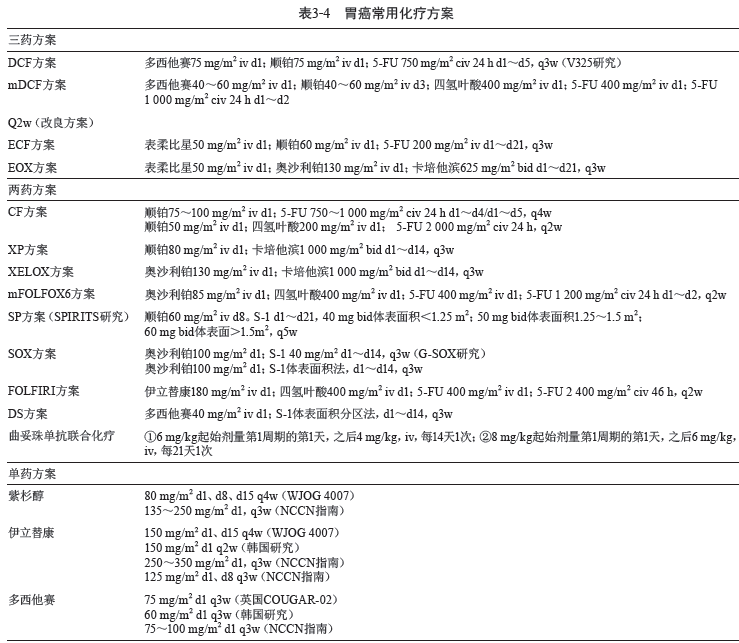
从晚期胃癌全身化疗研究观察,无论在国内还是国际,含有第三代铂类、口服氟尿嘧啶衍生制剂、紫杉烷类等新药已成为晚期胃癌一线化疗的主流。胃癌药物治疗主要有以下几类,见表3-3。

上述几类新药均各具特点,具体用法用量见表3-4。如卡培他滨(CAPE)在肿瘤细胞内选择性激
(一) 一线治疗
1. 双药方案 一般首选氟尿嘧啶和铂类联合的双药方案。
CF :5-FU +顺铂
该方案的顺铂可以用奥沙利铂代替,即mFOLFOX6 ;5-FU 可以分别由替吉奥或卡培他滨代替分别形成SP 或XP 方案;SOX 方案及XELOX方案也是很好的选择。
对于HER2 阳性患者可以在上述方案基础上加用曲妥珠单抗治疗。
紫杉醇或多西他赛与氟尿嘧啶类组成的双药方案也可以使用,但目前这类方案联合曲妥珠单抗的循证医学证据不足。
2. 三药方案 毒性较大,一般应用于身体情况较好、急于减瘤的患者。常用方案有:
ECF 方案:现在多用EOX 方案代替,REAL2 试验证实EOX 方案毒副作用有所下降但疗效相同。
DCF 方案:原方案毒性较大,多用改良的mDCF或DOX 方案。
3. 单药方案 如患者不能耐受强烈初始治疗,可考虑使用单药输注5-FU/LV 或口服卡培他滨或替吉奥的单药治疗。
(二) 二线治疗
对于一线化疗选用过铂类的患者,二线推荐单药紫杉醇/ 多西他赛或伊立替康[4]。
国外RAINBOW 研究证实二线用紫杉醇联合ramucirumab(雷莫芦单抗)优于单药紫杉醇,但该方案在亚洲人群中循证医学证据尚不足[10]。
对于一线化疗选用紫杉烷类药物的患者,二线可以考虑选用一线含铂方案。
(三) 三线治疗
阿帕替尼单药治疗。晚期胃癌标准化疗失败后的小分子抗血管生成靶向药物,有出血倾向者慎用。
(四) 最佳支持治疗
多数晚期胃癌患者营养状况差。最佳支持治疗是为了满足患者的日常营养需求,增强自身的抗病能力,减轻晚期胃癌患者的痛苦,缓解其主要症状,提高患者生存质量。支持治疗其实贯穿于肿瘤患者整个治疗过程中,对于不能接受化疗的晚期患者显得尤为重要。
晚期胃癌目前的治疗效果不尽如人意,建议患者在治疗的各个时期如果有机会应积极参加正规的临床试验,有可能获得意想不到的收获。
三、 评估与调整
1. 初次治疗前 应充分评估患者体能状况,KPS评分及ECOG 评分,评估患者各器官功能状况。状况良好的患者给予足剂量化疗方案,状况较差的患者给予个体化治疗,适当减量或改为单药治疗。
2. 化疗期间 充分评估毒副反应,建议参考CTCAE v4.0 确定不良反应分级,出现毒副反应应积
3. 疗效评估 推荐按照RECIST 1.1 版标准进行,一般患者进行2 ~ 3 周期化疗后复查CT 或MRI 评估疗效。如果患者病情进展,疗效判定为PD,原则上需要更换化疗方案或予以最佳支持治疗。换药原则参考上文所述。需注意患者前期治疗疗效佳,对于治疗间歇期发现病情进展者,若前一次化疗后疗效维持时间长达6 个月,可以考虑恢复原方案化疗。
四、 晚期胃癌的靶向治疗
曲妥珠单抗、阿帕替尼。针对VEGFR2 的雷莫芦单抗因未在国内上市,不在本节讨论范围。
曲妥珠单抗是针对HER2 的人源化单克隆抗体,可以与HER2 胞外区结合抑制下游信号转导。曲妥珠单抗抗肿瘤的作用机制主要为:抑制HER2 与其他HER 家族受体形成异源二聚体;抗体依赖的细胞介导的细胞毒作用(ADCC);抑制信号转导和细胞周期阻滞;抑制肿瘤血管生成以及抑制DNA 损伤修复等[11]。在ToGA 研究中,曲妥珠单抗对HER2 阳性晚期胃癌患者有显著延长无进展生存期(PFS)和总生存期(OS)的作用[9]。
能够从曲妥珠单抗治疗中获益的患者仅限于肿瘤组织HER2 IHC 为3 +或2 +且FISH 阳性的患者,因此必须行HER2 检测且HER2 阳性方可使用曲妥珠单抗。目前建议氟尿嘧啶类联合铂类方案与曲妥珠单抗联合用于一线治疗HER2 阳性的晚期胃癌患者。紫杉烷类药物联合曲妥珠单抗目前有小型临床研究,但缺乏大型临床研究数据。在一线进展后是否跨线使用曲妥珠单抗,或者二线使用曲妥珠单抗也有初步的临床数据,但仍缺乏大型临床研究证实[12]。
使用剂量:曲妥珠单抗初次负荷量8 mg/kg,之后每3 周6 mg/kg。
不良反应:主要包括心肌毒性、输液反应、血液学毒性和肺毒性等。因此在首次输注时需严密监测输液反应,并在治疗期间密切监测左室射血分数(LVEF)。
阿帕替尼为一种小分子血管内皮细胞生长因子受体2(VEGFR-2)酪氨酸激酶抑制剂,可抑制肿瘤血管生成。适用于既往至少接受过两种系统化疗后进展或复发的晚期胃腺癌或胃食管结合部腺癌患者[13-14]。
使用剂量:推荐剂量850 mg,qd。根据患者的临床表现,可适当降低剂量,最佳剂量仍在探索中。
不良反应:血压升高、蛋白尿、手足综合征、出血、心脏毒性和肝脏毒性等。治疗过程中需严密监测出血风险、心电图和心脏功能、肝脏功能等。
参考文献
[1] Siegel RL,Miller KD,Jemal A. Cancer statistics,2015. CA Cancer J Clin,2015,65(1):5-29.
[2] Chen W,Zheng R,Baade PD,et al. Cancer statistics in China,2015. CA Cancer J Clin,2016,66(2):115-132.
[3] 胃癌HER2检测指南(2016)专家组. 胃癌HER2检测指南(2016版). 中华病理学杂志,2016,45(8):528-532.
[4] Bölke E,Peiper M,Budach W. Capecitabine and oxaliplatin for advanced esophagogastric cancer. N Engl
[5] Sun P,Xiang JB,Chen ZY. Meta-analysis of adjuvant chemotherapy after radical surgery for advanced gastric cancer. Br J Surg,2009,96(1):26-33.
[6] Sakuramoto S,Sasako M,Yamaguchi T,et al. Adjuvant chemotherapy for gastric cancer with S-1,an oral fluoropyrimidine. N Engl J Med,2007,357(18):1810-1820.
[7] Noh SH,Par k S R ,Yang HK,et a l . Adjuva n t capecitabine plus oxaliplatin for gastric cancer after D2 gastrectomy(CLASSIC):5-year follow-up of an open-label,randomised phase 3 trial. Lancet Oncol,2014,15(12):1389-1396.
[8] Chung HT,Shakespeare TP,Wynne CJ,et al. Evaluation of a radiotherapy protocol based on INT0116 for completely resected gastric adenocarcinoma. Int J Radiat Oncol Biol Phys,2004,59(5):1446-1453.
[9] Bang YJ,Van Cutsem E,Feyerei s lova A,et al . Trastuzumab in combination with chemotherapy versus
[10] Wilke H,Muro K,Van Cutsem E,et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel in patientswith previously treated advanced gastric or gastrooesophageal junction adenocarcinoma(RAINBOW):a double-blind,randomised phase 3 trial. Lancet Oncol,2014,15(11):1224-1235.
[11] Pazo Cid RA,Anton A. Advanced HER2-positive gastric cancer:Current and future targeted therapies. Crit Rev Oncol Hematol,2013,85(3):350-362.
[12] Li Q,Jiang H,Li H,et al. Efficacy of trastuzumab beyond progression in HER2 positive advanced gastric cancer:a multicenter prospective observational cohort study. Oncotarget,2016.
[13] Li J,Qin S,Xu J,et al. Apatinib for chemotherapyrefractory advanced metastatic gastric cancer:results from a randomized,placebo-controlled, parallelarm, phase Ⅱ trial. J Clin Oncol,2013,31(26):3219-3225.
[14] Li J,Qin S,Xu J,et al. Randomized,Double-Blind,Placebo-Controlled Phase Ⅲ Tr i a l of Apatinib in Patients With Chemotherapy-Refractory Advanced or Metastatic Adenocarcinoma of the Stomach or Gastroesophageal Junction. J Clin Oncol,2016,34(13):1448-1454.
来源:国家卫生计生委合理用药专家委员会
|
关于 |
联系我们 |
友情链接 |
|

|
|
|||||||
| 公司简介 | 客服QQ:749176416 | 埃帕无线 | ||||||||||
| 最新资讯 | 客服QQ:264672391 | |||||||||||
| 产品中心 | 客服电话:021-54191803 客服电话:13162533752 |